Esempi sul calcolo della massa molare. A) Determinare la massa molare del carbonio. Svolgimento: il carbonio (simbolo C) è uno degli elementi chimici fondamentali, quindi il suo peso atomico può essere letto direttamente sulla tavola periodica. Massa molecolare (peso molecolare) è la massa di una molecola di una sostanza ed è espresso in unità di massa atomica (u). Pesi di atomi e gli isotopi sono da NIST articolo.

Il carbonio ha tre isotopi naturali e disponibili in natura. La massa molare e il peso molecolare di CCl- Tetracloruro Di Carbonio è 15823. Questa è la massa di un singolo atomo dell’isotopo del carbonio. Come potete vedere, esprimere la massa di un atomo in grammi (o in chili) è quantomeno scomodo. Dalla formula sappiamo che: mole di etano produce moli di diossido di carbonio.
Anche il concetto di mole è legato al carbonio-12. Prima di arrivare alla risposta, riprendiamo quindi alcune definizioni fondamentali. Ogni atomo ha una massa , che chiamiamo massa atomica (m a).
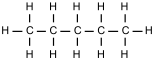
Ma quando si tratta di massa molare dei composti, il primo passo è calcolare la sua massa molecolare, che è la somma delle masse atomiche degli elementi costituenti. C Calcolo del peso atomico dalle abbondanze isotopiche. Le masse molari delle varie sostanze (atomi, molecole, ioni) stanno tra loro nello stesso rapporto numerico delle rispettive masse atomiche o molecolari relative, con il vantaggio di poter essere valutate con la bilancia.
Qual è la differenza tra massa molare e peso molecolare - Confronto delle differenze chiave. In generale, la massa di una mole di atomi di un certo elemento è un numero di grammi pari alla massa atomica dell’elemento. L’esempio pratico è ancora una volta rappresentato dal carbonio isotopo di cui sappiamo che il peso di una mole di atomi è pari a 1g. Pertanto possiamo concludere che la Massa Molare.

Il tuo campione contiene il carbonio -e il carbonio -13. Un testo di riferimento ti fornirà le proporzioni percentuali di tutti gli isotopi di un elemento. Carbonio(ove per Carboniosi intende il Carbonio con peso molecolare =12) perciò una mole di Carbonio a peso molecolare pesa grammi. La massa atomica può essere calcolata essenzialmente in due modi: assoluto o relativo.
La misurazione assoluta della massa atomica. Avogadro di atomi di idrogeno. Puoi passare liberamente tra le quantità in grammi, moli e particelle.

Per determinare la quantità chimica di un campione, usiamo la massa molare (M) della sostanza, la massa per mole di particelle. Useremo il carbonio -come esempio, perché è lo standard per la definizione formale della mole. Secondo la definizione, una mole di carbonio -ha una massa di esattamente grammi. Massa molare è la massa di mole of in grammi uova scarpe marmi atomi mole atomi 12C = 6. C mole atomi litio= 6. L i Per ogni elemento massa atomica (uma) = massa molare (grammi) 3. In alcuni casi si usa il termine più generale di peso formula (o massa formula ) che può essere riferito ai composti sia molecolari sia ionici, e a tutte le specie rappresentabili con una formula, come atomi e ioni (atomi o gruppi di atomi con un eccesso di carica elettrica).
Massa molecolare e massa molare La massa della molecola o massa molecolare di un composto chimico è la massa di una singola molecola di tale composto, espressa in unità di massa atomica (u.m.a o dalton). La massa molecolare può essere calcolata come la somma delle masse atomiche di tutti gli atomi costituenti la molecola. Determinate la media della massa atomica (peso atomico) di ciascun elemento. Immagino che un ingegnere o un chimico industriale ti possano dare informazioni più precise.
Idrogeno molecolare (H- Massa molecolare), massa molare Digitare il numero di Idrogeno molecolare (H2) che si desidera convertire nella casella di testo per visualizzare i risultati nella tabella. A temperatura e pressione di riferimento standar ( 0°C = 27K, 32°F ) e (bar) l’ossigeno è in forma gassosa ed è formato da due atomi. Il suo simbolo è: Oed è di colore azzurro allo stato liquido e solido, altamente paramagnetico.
Nessun commento:
Posta un commento
Nota. Solo i membri di questo blog possono postare un commento.